Cell Reports|3344体育官方入口林古法/程黎明团队揭示无RNA识别基序的MSI1-C蛋白在胚胎干细胞多能态调控中的关键作用
RNA结合蛋白(RNA Binding Protein, RBP)可以调节基因转录后的表达。Musashi1(MSI1)是一个在进化中保守的RBP,包含两个N端RNA识别基序(RRM1和RRM2)。过去的研究表明MSI1通过这两个结构域与RNA结合,从而调控RNA的稳定性和翻译过程。MSI1能够调控各种成体干细胞,如神经干细胞和肠上皮干细胞的增殖和分化。MSI1也是Yamanaka重编程备选因子之一,因为它在爪蛙和小鼠的卵母细胞中表达,并参与调节卵母细胞成熟过程中的mRNA翻译。这暗示MSI1在早期胚胎发育中可能发挥作用。然而,关于MSI1在胚胎干细胞中的作用,以往的研究并没有提供明确的答案。
2023年10月18日,Cell Reports期刊在线发表了来自3344体育官方入口林古法/程黎明团队题为“Short C-terminal Musashi-1 proteins regulate pluripotency states in embryonic stem cells”的研究论文。该研究证明,在naïve态胚胎干细胞(Embryonic stem cell, ESC) 中存在缺少N端RRM的短MSI1-C蛋白,在维持人与小鼠胚胎干细胞的多能性以及调节胚胎早期发育中起着重要的作用(图1)。MSI1-C蛋白能够促进primed态人胚胎干细胞向naïve态的转化。在naïve态下,MSI1-C蛋白可以调节多能性基因的mRNA稳定性。此外,研究人员还发现,尽管缺少RRM,MSI1-C蛋白能够与DNA损伤修复相关基因的RNA结合,从而促进胚胎干细胞的DNA损伤修复,维护基因组的稳定性,并提高类囊胚形成的能力。
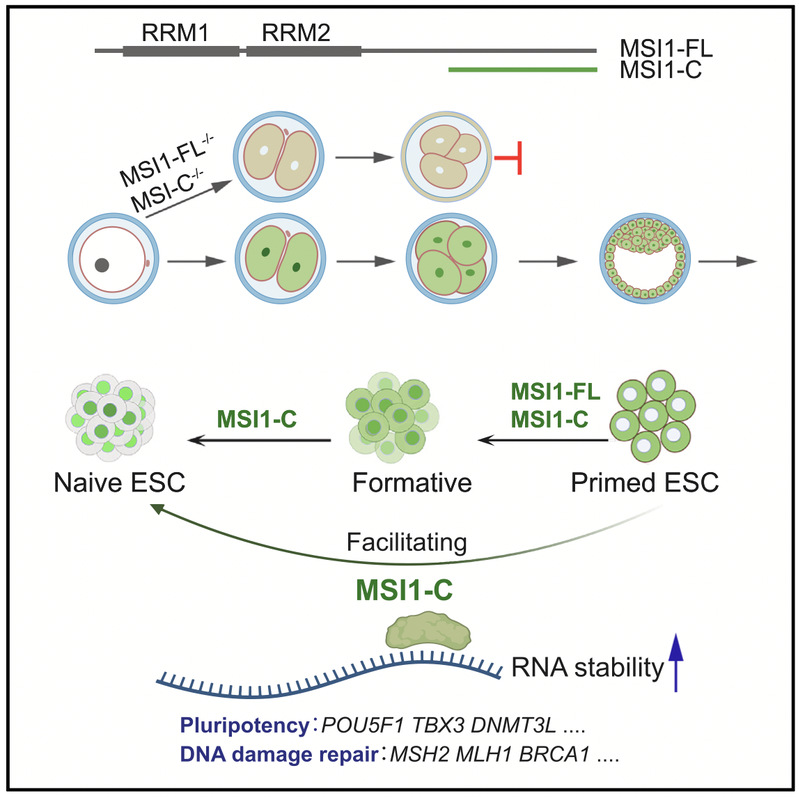
图1.MSI-C蛋白在胚胎干细胞多能态调控中的作用示意图
该团队的研究人员在将H9 hESC向神经干细胞诱导分化的过程中观察到了MSI1在未经神经诱导的H9 hESC中表达。研究团队发现MSI1的亚细胞定位在人类和小鼠ESC中存在差异:在R1 mESC中,它定位于细胞核,而在H9 hESC中,它定位于细胞质;而与之同源的MSI2的定位则没有差异。研究者还观察到,当他们诱导R1 mESC进入primed态时,MSI1从细胞核转移到了细胞质,而将H9 hESC诱导进入naïve态(H9-5i hESCs)后,MSI1则迁移到了细胞核中。此外,研究团队还研究了小鼠胚胎发育过程中在E3.5(着床前)和E5.5(着床后)两个阶段的MSI1表达情况,这两个阶段分别对应着胚胎干细胞的naïve和primed状态。结果显示,MSI1信号主要定位于E3.5胚胎的细胞核中,而在E5.5胚胎中,MSI1信号则主要分布在细胞质中。
在这一基础上,研究人员使用CRISPR-Cas9系统来敲除MSI1基因。人类和小鼠的MSI1基因都包含15个外显子,其中1-14号外显子编码全长的MSI1蛋白(MSI1-FL),而1-5号外显子编码RRM1。他们尝试删除hMSI1基因的1-14号或1-9号外显子,但未能获得任何可以增殖的细胞克隆,这表明MSI1对于人类胚胎干细胞(hESCs)的存活至关重要。鉴于以前的研究表明破坏MSI1的RRM1并不会影响胚胎发育,接下来,他们尝试通过敲除hMSI1的1-7号外显子来删除RRM1。研究人员成功获得了一个可增殖的H9细胞系,被命名为H9-C8。尽管Western blot证实了MSI1蛋白的敲除,但H9-C8细胞系保持了典型的hESC克隆形态,可以正常进行细胞传代,而且没有显示出任何分化的迹象。此外,RT-qPCR分析显示H9-C8细胞中POU5F1、NANOG和SOX2的表达水平与H9-WT细胞相似。这表明,敲除MSI1基因的全长(MSI1-FL)会导致hESCs的死亡,但仅仅敲除RRM1并不会导致hESCs失去其多能性。
研究人员通过5'RACE技术发现在H9-C8细胞中存在一个来自hMSI1的短转录本,该转录本由12-14号外显子编码,产生了一个以前未曾报道的短蛋白。研究团队将这一蛋白命名为MSI1-C。值得注意的是,敲除MSI1-C蛋白会导致H9-C8细胞的分化和死亡,这表明在敲除MSI1-FL蛋白后,MSI1-C蛋白在维持多能性方面发挥了关键作用。此外,研究人员还在R1 mESCs和H9-5i hESCs中发现额外的MSI1-C。
研究人员进一步发现,MSI1-C不仅在胚胎干细胞中表达,还存在于卵巢、受精卵和早期囊胚中。因此,他们重新构建了敲除MSI1-C和MSI1-FL的Msi1-/-小鼠,发现在这些纯合子小鼠胚胎中发生了早期发育停滞。此外,特异性敲除MSI1-C同样导致了mESCs的多能性丧失,但重新表达MSI1-C可以挽救多能性丧失的趋势,这表明MSI1-C在早期胚胎发育和多能性维持中扮演着重要的角色。这些研究结果强调了MSI1-C蛋白在胚胎发育、多能性维持以及胚胎干细胞中的关键作用,为我们对这些生物学过程的理解提供了新的见解。
与RRM相比,MSI1的C末端区域受到较少关注,因为它包含内在无序区域(IDR),这使研究其结构变得具有挑战性。尽管有证据表明MSI1的C末端结构域可能与RNA相互作用,但这种结合的生物学功能尚未充分研究。为了深入探究MSI1-C在维持胚胎干细胞多能性方面的机制,研究人员采用了RIP-seq和点击化学等方法,证明MSI1-C蛋白能够与DNA损伤修复基因的RNA结合,如MLH1、MSH2和BRCA1等,从而在调控胚胎干细胞的DNA稳定性中发挥了关键作用。此外,研究人员还发现,过表达MSI1-C蛋白会使primed态人胚胎干细胞在转录水平上更接近于formative态,而且MSI1-C还能增强人胚胎干细胞的抗应激能力,提高它们在种间细胞竞争中的存活率,并增加形成类囊胚的能力。
因此,本研究证明了人和小鼠naïve态胚胎干细胞中存在MSI1-C蛋白,揭示了MSI1-C蛋白在早期胚胎发育及胚胎干细胞中的重要生物学功能。MSI1-C可作为获得naïve态胚胎干细胞的附加因子,且MSI1-C在增强氧化应激抵抗力和促进DNA损伤修复方面的作用也可用于其他目的,如提高移植细胞在受损组织中的存活率,为干细胞移植和再生医学提供新的思路。
3344体育官方入口、医学院及脊柱脊髓损伤再生修复教育部重点实验室林古法教授、程黎明教授为该论文的共同通讯作者。陈有为博士为该论文的第一作者,参与此项研究工作的还有陈瑛博士,及3344体育官方入口的研究生李千妍、刘华华、韩嘉臻、张海林。该项工作得到了国家自然科学基金、科技部重点研发计划的支持。
Copyright© 2011-2015 3344体育官方入口 - 3344体育网平台
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


