Cell Reports高义萌/Stephanie Halene团队合作揭示ALKBH5在能量代谢和压力造血中的重要作用
造血干细胞(hematopoietic stem cell, HSC)在发育成熟的过程中,会经历由糖酵解(glycolysis)到氧化磷酸化(oxidative phosphorylation, OXPHOS)的能量代谢转变过程。早期的HSCs主要依赖于糖酵解提供能量,而成熟血细胞则主要依赖于氧化磷酸化提供能量。但是这一能量转换过程的调控机制并不清楚。N6-甲基腺苷(m6A)RNA修饰是生物体内含量最多的RNA内源修饰,调控诸多生物学过程1,2。m6A去甲基化酶ALKBH5的含量在HSC分化为成熟细胞的过程中,呈现出由低到高的变化。针对白血病病人的基因表达数据库分析也发现ALKBH5的表达水平在急性髓系白血病(acute myeloid leukemia,AML)病人样本中显著升高,说明ALKBH5对于血液发育和稳态维持具有重要作用3-6。但是,ALKBH5在造血发育中调控的靶基因和其对HSC分化成熟的意义并不清楚。
2023年9月23日,3344体育官方入口/上海市东方医院(3344体育官方入口附属东方医院)高义萌研究员联合耶鲁大学Stephanie Halene教授团队在Cell Reports杂志发表论文ALKBH5 Modulates Hematopoietic Stem and Progenitor Cell Energy Metabolism through m6A Modification-Mediated RNA Stability Control(图1)。该论文发现ALKBH5缺失引起m6A修饰在RNA上的异常积累会导致Ogdh为代表的代谢酶相关转录本RNA稳定性发生下调,以及异常代谢产物L-2-羟基戊二酸(L-2-Hydroxyglutarate,L-2-HG)的积累,从而抑制三酸酸循环的能量生成过程,进而抑制造血干细胞在压力造血过程中的适应性。

图1. 文章截图
本研究利用Vav1-iCre; Alkbh5条件性敲除小鼠模型,在造血系统中特异性敲除m6A去甲基化酶ALKBH5,以此来观察m6A积累对造血系统的影响。发现ALKBH5缺失会导致造血干细胞在骨髓竞争性移植实验中出现增殖分化障碍。通过TimeLapse-seq在转录组水平检测RNA稳定性,发现ALKBH5的调控目标是酮戊二酸脱氢酶(oxoglutarate dehydrogenase,OGDH)为代表的代谢酶相关的转录本。而OGDH是三羧酸循环的限速酶,其RNA表达水平在HSC向成熟血细胞分化的过程中同样呈现出由低到高的变化趋势。提示ALKBH5可能通过m6A修饰来调控OGDH等代谢酶的RNA稳定性,从而高效完成HSC分化成熟过程中从糖酵解到氧化磷酸化的能量转换过程。因此,在ALKBH5缺失的情况下,OGDH的RNA稳定性下降,进而导致蛋白表达量减少,会阻碍氧化磷酸化介导的ATP生产过程;此外,OGDH减少本身也会抑制三羧酸循环中α-酮戊二酸(α-ketoglutarate,α-KG)到琥珀酰辅酶A(succinate-CoA)的转换过程,导致非常规代谢产物L-2-HG的积累,其可以进一步抑制氧化磷酸化的能量生成过程。对血液肿瘤细胞进行处理,发现L-2-HG的积累亦可通过抑制能量代谢过程减弱AML细胞的增殖速率,为日后血液疾病治疗提供了新的思路。
综上所述,该研究利用ALKBH5条件性敲除小鼠模型和压力造血测试揭示了RNA m6A修饰作为造血干细胞分化成熟过程中能量代谢调控介质的生物学意义。并通过对非常规代谢产物L-2-HG的检测加深对于ALKBH5在AML中高表达意义的理解,为后续血液疾病的治疗提供了新的思路(图2)。
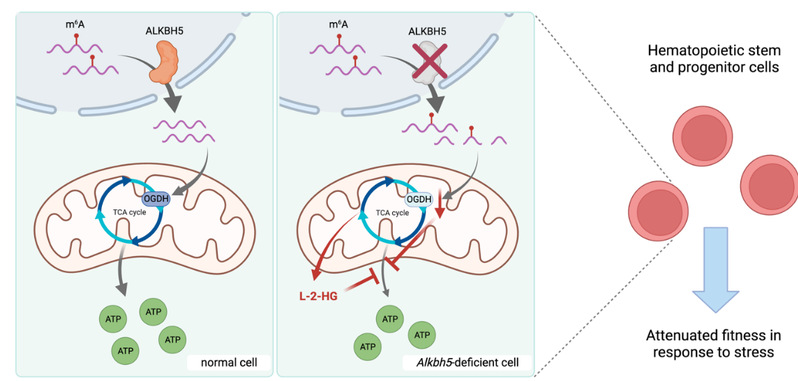
图2. ALKBH5通过调控RNA稳定性影响压力造血过程中的能量生成过程
高义萌研究员和Stephanie Halene教授为该论文共同通讯作者。高义萌研究员为本文第一作者。该工作的完成得益于上海交通大学医学院李华兵教授、耶鲁大学Andrew Z. Xiao教授、Sarah Slavoff 教授、Matthew D. Simon教授、Richard A. Flavell教授、Richard G. Kibbey 教授和意大利Trento大学Toma Tebaldi助理教授等的大力支持。该研究得到了国家自然科学基金委、教育部细胞干性与命运编辑前沿科学中心、美国血液学会等项目的支持。
参考文献
1.Gao, Y., Vasic, R., Song, Y., Teng, R., Liu, C., Gbyli, R., Biancon, G., Nelakanti, R., Lobben, K., Kudo, E., et al. (2020). m(6)A Modification Prevents Formation of Endogenous Double-Stranded RNAs and Deleterious Innate Immune Responses during Hematopoietic Development. Immunity 52, 1007-1021.e1008. 10.1016/j.immuni.2020.05.003.
2.Vasic, R., Gao, Y., Liu, C., and Halene, S. (2020). The role of RNA epigenetic modification in normal and malignant hematopoiesis. Curr Stem Cell Rep 6, 144-155. 10.1007/s40778-020-00178-y.
3.Wang, J., Li, Y., Wang, P., Han, G., Zhang, T., Chang, J., Yin, R., Shan, Y., Wen, J., Xie, X., et al. (2020). Leukemogenic Chromatin Alterations Promote AML Leukemia Stem Cells via a KDM4C-ALKBH5-AXL Signaling Axis. Cell Stem Cell 27, 81-97. 10.1016/j.stem.2020.04.001.
4.Shen, C., Sheng, Y., Zhu, A.C., Robinson, S., Jiang, X., Dong, L., Chen, H., Su, R., Yin, Z., Li, W., et al. (2020). RNA Demethylase ALKBH5 Selectively Promotes Tumorigenesis and Cancer Stem Cell Self-Renewal in Acute Myeloid Leukemia. Cell Stem Cell 27, 64-80. 10.1016/j.stem.2020.04.009.
5.Liu, Y., You, Y., Lu, Z., Yang, J., Li, P., Liu, L., Xu, H., Niu, Y., and Cao, X. (2019). N (6)-methyladenosine RNA modification-mediated cellular metabolism rewiring inhibits viral replication. Science 365, 1171-1176. 10.1126/science.aax4468.
6.Zhou, J., Zhang, X., Hu, J., Qu, R., Yu, Z., Xu, H., Chen, H., Yan, L., Ding, C., Zou, Q., et al. (2021). m(6)A demethylase ALKBH5 controls CD4(+) T cell pathogenicity and promotes autoimmunity. Science Advances 7. 10.1126/sciadv.abg0470.
Copyright© 2011-2015 3344体育官方入口 - 3344体育网平台
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


