杜昌升教授课题组发现抑制趋化因子受体CXCR1能够减轻炎症性自身免疫疾病临床症状
2023年9月14日,Cell Death & Disease杂志在线发表了3344体育官方入口杜昌升教授课题组完成的题为“CXCR1 drives the pathogenesis of EAE and ARDS via boosting dendritic cells-dependent inflammation”的研究论文。本文通过构建小鼠实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)模型和急性肺损伤(Acute respiratory distress syndromes, ARDS)模型,发现趋化因子受体CXCR1调控树突状细胞炎症因子产生能力进而参与疾病进程。
多发性硬化症(Multiple sclerosis,MS)是一种慢性、炎性、中枢神经系统(Central nervous system,CNS)脱髓鞘引起的神经退行性疾病。MS发病起源于外周免疫系统,炎性Th1和Th17细胞等在外周免疫系统被抗原递呈细胞分泌的细胞因子激活,然后穿过血脑屏障,进入CNS产生炎症产物和细胞因子从而扩大相应炎性细胞环境,导致CNS局灶性淋巴细胞浸润以及神经系统综合征和身体的残疾。其发病机制仍在研究,目前尚未有药物可以逆转或完全预防MS。因此,从疾病本身出发寻找可能的作用机制,为将来的新药物开发提供更可靠的药物靶点势在必行。
本研究中,我们在MS患者中发现趋化因子受体CXCR1表达明显升高。为此,我们首先构建了CXCR1全身敲除小鼠,我们发现敲除CXCR1后CNS中炎症细胞浸润情况减轻,EAE临床症状缓解。我们进一步发现,敲除CXCR1小鼠并不直接影响体外Th1和Th17细胞的产生。基于此,我们分析发现CXCR1通过影响树突状细胞的炎症因子分泌能力,进一步影响T细胞分化。这一结论在条件敲除小鼠(树突状细胞条件敲除CXCR1)和CXCR1配体CXCL5中和抗体动物模型中均得到了证实。机制研究中,我们发现树突状细胞体内存在CXCL5/CXCR1/HIF-1α正反馈调节环调控炎症因子(IL-6和IL-12)生成。在急性肺损伤模型中我们印证了这一机制。总之,我们的工作表明抑制趋化因子受体CXCR1可减少树突状细胞的炎症反应,减轻炎症性自身免疫疾病的临床症状,这表明CXCR1可能是治疗炎症性自身免疫疾病的一种有希望的潜在药物靶点。
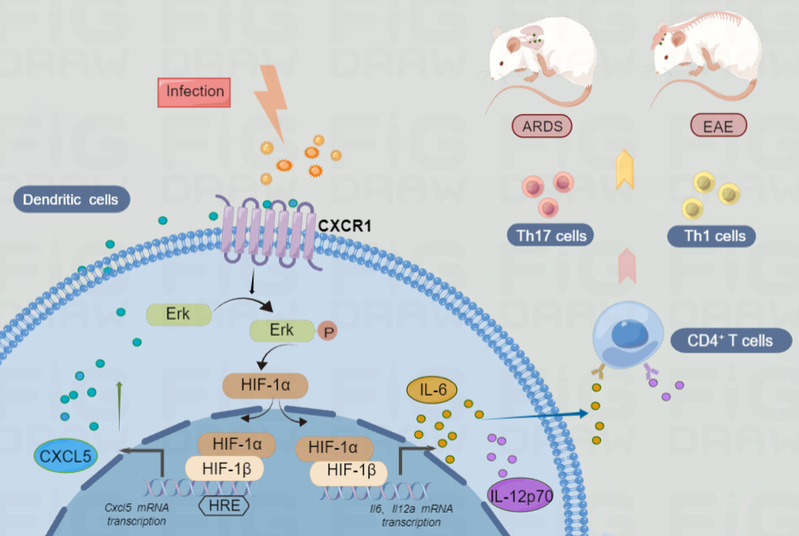
图1:CXCR1通过CXCL5/CXCR1/HIF-1α正反馈环调控树突状细胞的炎症反应,促进T细胞分化,加重EAE和ARDS疾病进程,这些发现提示CXCR1将成为炎症性自身免疫疾病治疗的新突破口。
本研究在杜昌升教授指导下完成。论文的第一作者为来自3344体育官方入口博士研究生庄伟,周金凤和上海市东方医院南院消化内科的钟岚教授。参与此项研究工作的还有3344体育官方入口的吕婕老师,上海东方医院研究生钟旋,研究生谢玲、王纯、韩三省、凯迪热亚·赛买尔以及3344体育官方入口上海信号转导与疾病研究重点实验室的谢欣老师、张儒老师、石昌杰老师和花秋红老师。杜昌升教授为本论文的独立通讯作者。以上研究得到国家自然科学基金的资助。
Copyright© 2011-2015 3344体育官方入口 - 3344体育网平台
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


