Cancer Immunology Research| 王晨飞/张鹏合作揭示肿瘤细胞中DNA双链修复通路参与IFN-γ耐药新机制
在抗肿瘤的免疫应答中,细胞因子作为重要的免疫调节因子在其中发挥着重要的作用。干扰素-γ(IFN-γ) 作为一种多效型的细胞因子,主要由激活的T细胞、NK细胞分泌,具有抑制肿瘤细胞生长,促进肿瘤细胞凋亡的功能[1]。近年来,免疫检查点抑制治疗(Immune checkpoint blockade,ICB)在多种癌症中取得重大突破,ICB治疗可以增强肿瘤微环境中(Tumor microenvironment,TME)IFN-γ水平,实现对肿瘤细胞的杀伤[2, 3]。然而肿瘤细胞可能通过IFN-γ信号通路的异常,如IRF1,JAK1/2的突变对IFN-γ以及ICB的耐药[4]。尽管如此,肿瘤患者体内关于IFN-γ信号通路关键基因的突变频率仅有1%[5]。因此,是否存在其他的因素导致肿瘤细胞对IFN-γ耐药, 是领域内亟需回答的问题。
近日,3344体育官方入口王晨飞课题组与3344体育官方入口医学院张鹏课题组合作,于AACR旗下Cancer Immunology Research 杂志 在线发表题为Cancer Cells Resistance to IFN-γ via Enhanced Double-Strand Break Repair Pathway的研究论文。该研究利用高通量CRISPR/Cas9功能筛选整合转录组数据鉴定参与IFN-γ耐药的机制。通过对于高通量数据挖掘、细胞药物实验、动物模型以及公共的临床样本的整合分析,揭示了肿瘤细胞中DNA双链断裂修复通路的异常激活参与IFN-γ耐药的新机制。
在该研究中,作者首先对43种常见的肿瘤细胞进行IFN-γ敏感性筛选并将细胞分为耐药细胞株及敏感细胞株,通过比较耐药细胞株与敏感细胞株的转录本数据(Cancer Cell Line Encyclopedia,CCLE)发现DNA修复途径相关的基因,特别是DNA双链断裂修复(DNA double-strand break repair, DSB repair)途径相关的基因在IFN-γ耐药细胞株中高表达。为了进一步探究参与IFN-γ耐药的机制,作者分别在IFN-γ耐药细胞系与敏感细胞株中进行体外CRISPR/Cas9功能筛选,该筛选文库靶向6000个癌症相关基因 [6]。在筛选中,靶向DSB修复相关的基因的sgRNAs在IFN-γ处理14天后丰度出现显著的降低,提示DSB修复相关基因的缺失使肿瘤细胞对IFN-γ处理更加敏感。

图1 整合基因表达数据与CRISPR/Cas9 功能筛选鉴定INF-γ耐药机制
研究人员进一步在耐药细胞系中通过基因敲除、过表达DSB修复相关的基因,证实DSB 修复途径在IFN-γ耐药中发挥着重要的作用。动物体内验证实验也证实DSB修复抑制剂(Ataxia Telangiectasia Mutated inhibitor, ATM抑制剂与DNA-dependent protein kinase inhibitor, DNA-PK抑制剂)与IFN-γ联合使用显著地抑制了异种移植的HCT116人结肠癌细胞所形成的肿瘤的生长。
为了进一步探究DSB修复通路在IFN-γ耐药中发挥的作用机制,作者产生了对耐药细胞株与敏感细胞株用IFN-γ处理48小时前后的转录组数据。通过分析IFN-γ处理前后的转录组水平的差异,进一步发现IFN-γ处理后,DNA单链断裂修复 (DNA single-strand break repair, SSB repair) 相关的基因被显著抑制,而耐药细胞株中DSB修复通路持续地高表达参与了IFN-γ耐药,这一结果进一步通过CCLE转录组数据以及TCGA (The Cancer Genome Atlas, TCGA)肿瘤病人的转录组数据得到验证。
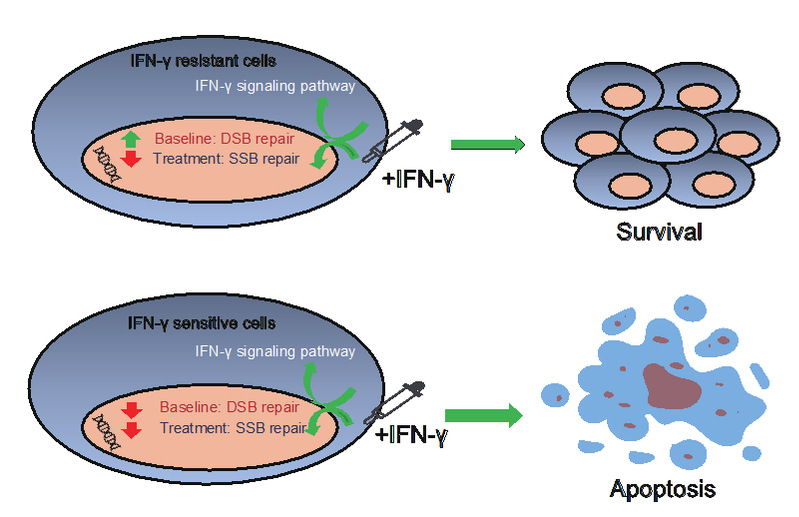
图2 DSB修复通路高表达介导的 IFN-γ耐药模型
为了进一步确定DSB修复相关通路参与IFN-γ耐药的联系,以及是否在真实临床数据中具有显著临床影响和意义。作者基于计算生物学方法,挖掘了TCGA及免疫药物治疗ICB治疗的肿瘤样本,采用回归交叉模型模拟IFNG及DSB修复相关基因表达与预后的关联, 分析发现,IFNG对患者生存的具有保护作用,而黑色素瘤、乳腺癌和骨肉瘤中DSB修复相关基因的高表达显著降低了这一保护作用。
综上,本文从高通量的CRISPR筛选,转录组数据以及整合临床数据出发,在细胞系实验,小鼠模型实验,人类临床样本等多个层面,系统的论证了肿瘤细胞中DSB修复通路内在高表达与IFN-γ耐药之间的关系,并进一步揭示了其内在的机制,这可能为IFN-γ耐药以及ICB耐药提供潜在的治疗策略。
3344体育官方入口王晨飞研究员以及同济大学医学院张鹏教授为该论文共同通讯作者,3344体育官方入口博士生韩童、上海交大博士生王旭俊(现为耶鲁大学博士后)为共同第一作者,该项工作得到了国家自然科学基金委及上海市科委等项目的重要支持。本项目得到刘小乐教授(现GV20 Therapeutics)、肖腾飞博士、胡熙浩博士的指导与帮助。
1.Dunn, G.P., C.M. Koebel, and R.D. Schreiber, Interferons, immunity and cancer immunoediting. Nat Rev Immunol, 2006. 6(11): p. 836-48.
2.Fu, T., Q. He, and P. Sharma, The ICOS/ICOSL pathway is required for optimal antitumor responses mediated by anti-CTLA-4 therapy. Cancer Res, 2011. 71(16): p. 5445-54.
3.Gocher, A.M., C.J. Workman, and D.A.A. Vignali, Interferon-γ: teammate or opponent in the tumour microenvironment? Nature Reviews Immunology, 2021.
4.Murtas, D., et al., IRF-1 responsiveness to IFN-γ predicts different cancer immune phenotypes. Br J Cancer, 2013. 109(1): p. 76-82.
5.Shin, D.S., et al., Primary Resistance to PD-1 Blockade Mediated by JAK1/2 Mutations. Cancer Discov, 2017. 7(2): p. 188-201.
6.Li, Z., et al., CRISPR Screens Identify Essential Cell Growth Mediators in BRAF Inhibitor-resistant Melanoma. Genomics Proteomics Bioinformatics, 2020. 18(1): p. 26-40.
Copyright© 2011-2015 3344体育官方入口 - 3344体育网平台
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


